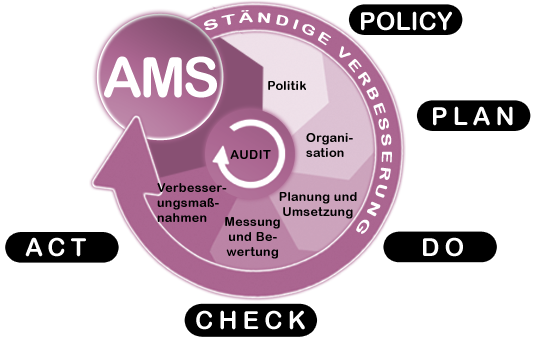
Nehmen Sie Kontakt auf.
Nehmen Sie Kontakt auf.
Ihre Vorteile mit uns als Arbeitsschutzpartner:
- Wir vermitteln unser Wissen und unsere Erfahrungen aus über 30 Jahren Praxis direkt an Sie.
- Wir finden die passende Lösung für Ihre Herausforderung und fertigen auch neue Individual-Lösungen an.
- Wir bieten Ihnen ein breites Spektrum an Leistungen und Produkten an: Von der intensiven Beratung bis hin zu Arbeitshilfen und Schulungsmaterialien.
- Wir sind ein starkes Team aus Ingenieuren, Medizinern und Gesundheitswirten. Die ergänzenden Kompetenzen und die Zusammenarbeit mit Arbeits- und Sozialwissenschaftlern ermöglichen auch die Lösung anspruchsvoller Aufgaben.
Wir freuen uns auf ein Gespräch mit Ihnen.